

近日,在 Microbiome 上发表了一篇名为 Effect of a multi-strain probiotic mixture consumption on anxiety and depression symptoms induced in adult mice by postnatal maternal separation 的研究。该研究构建了母体分离的(MS)的抑郁、焦虑动物模型,揭示了益生菌对早期应激诱发的抑郁、焦虑的治疗效果,并探讨其具体作用机制。

图源:Microbiome
研究内容
1. 益生菌可改善母体分离诱发的抑郁焦虑行为
该研究建立母体分离(MS)动物模型:将新出生的雄性小鼠,从出生后第 2 天到第 14 天,每天与生母分离 3 小时。在第 63 天到第 78 天每天口服 109 CFU/鼠/天的益生菌。78 天后对小鼠进行抑郁、焦虑行为测试,包括旷场实验(OFT)、高架十字迷宫(EPM)、强迫游泳实验(FST)。OFT 测试发现 MS 会导致小鼠在中心区逗留时间减少,在周边区逗留时间增加,这体现了小鼠探索欲望下降并更愿意隐藏在保护区域的焦虑行为特征。经过益生菌治疗,小鼠的上述行为模式得到改善,中心区逗留时间明显增加,并更愿意探索新环境。EPM 测试发现益生菌显著增加了小鼠在开放环境的逗留时间,这表明益生菌改善了焦虑行为。FST 测试也发现益生菌减少了小鼠静态漂浮行为(反映抑郁),体现了益生菌的抗抑郁作用。
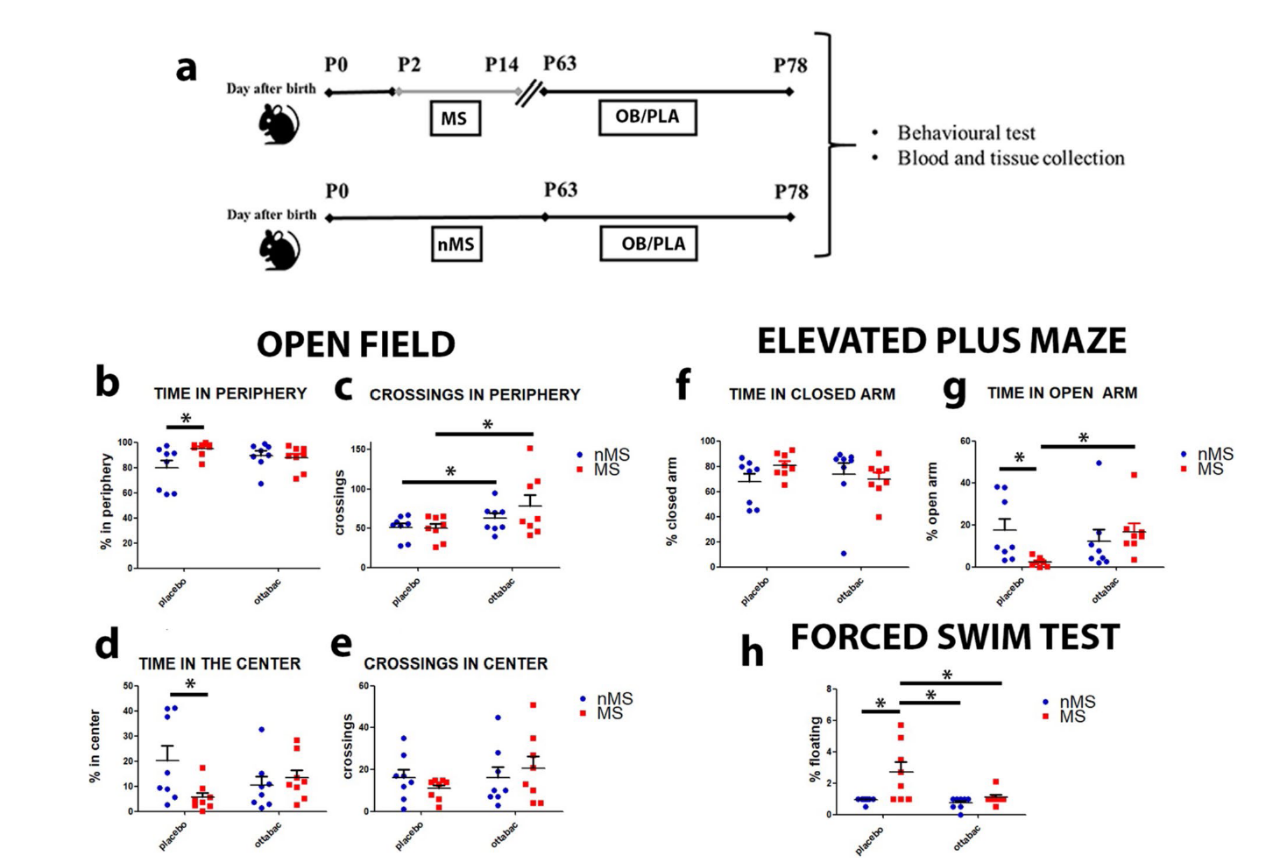
图源:Microbiome
2. 益生菌对母体分离小鼠前额叶皮质的有益作用
前额皮质(PFC)与抑郁焦虑密切相关,研究评估了 c-fos 基因的表达,该基因可反映神经元活动的差异情况。通过研究发现 MS 可导致该基因下调,而经过益生菌治疗后 c-fos 基因的表达得到恢复,神经元得以激活。PFC 处理应激信号与糖皮质激素受体(GR)有关,经过分析 PFC 细胞中 GR 的表达水平,发现经益生菌治疗该受体明显增加,提示益生菌具有抗应激作用。
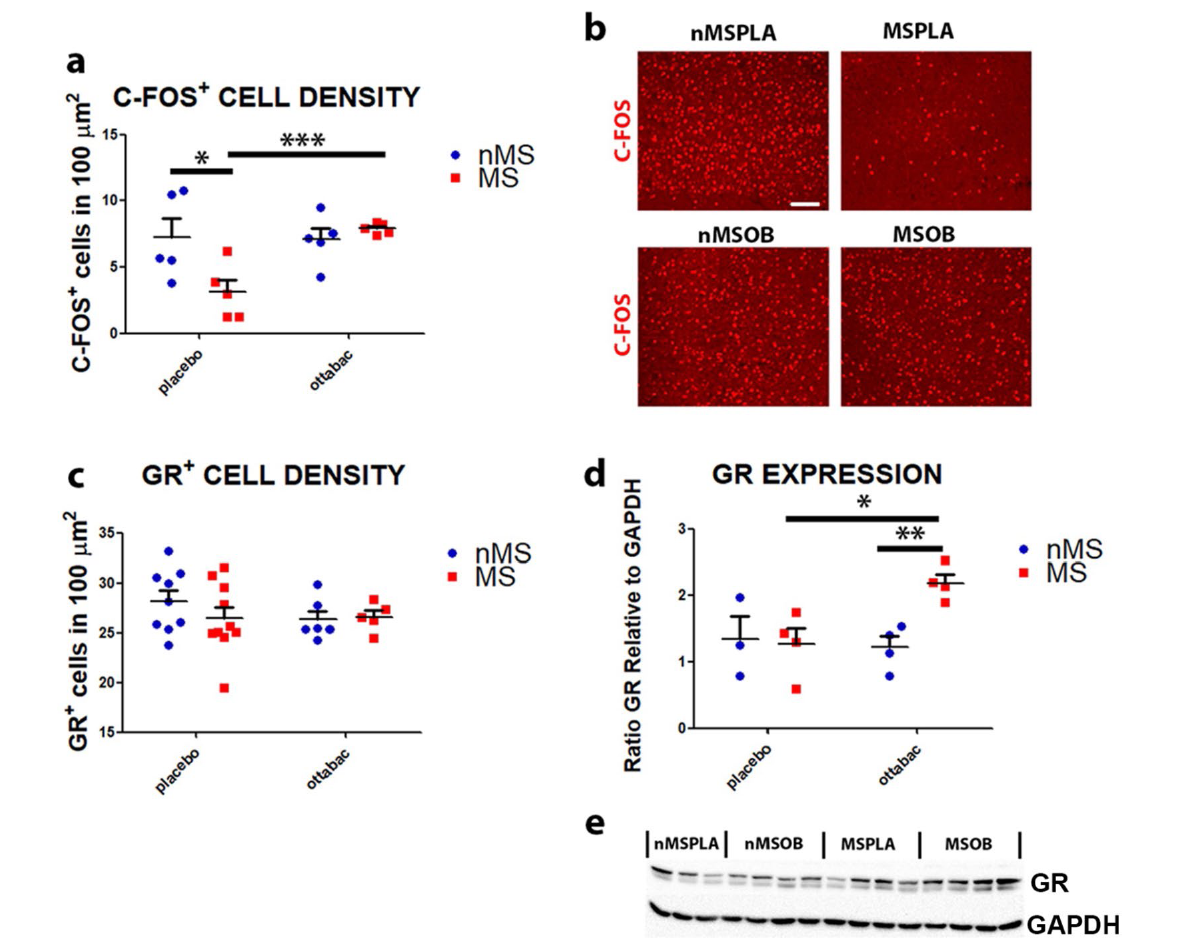
图源:Microbiome
3. 益生菌的抗炎症和神经发生作用
小胶质细胞是大脑中的免疫细胞,与炎症反应密切相关。早期应激事件可促使该细胞启动炎症反应。该研究检测了 PFC 中该细胞的密度及活化情况,发现 MS 组中小胶质细胞明显增加,表现出活化的形态。经过益生菌治疗,小胶质细胞的活化状态受到明显的抑制,细胞形态恢复到基础水平。并且 MS 可导致小胶质细胞的稳态基因下调,而益生菌可逆转这种基因的下调趋势。研究还发现益生菌可显著增加血清中的抗炎因子 IL-10。表明益生菌可发挥一定的抗炎作用,缓解 MS 带来的不利影响,并且益生菌治疗可使 GFP+细胞和 DCX+细胞增殖,有促神经发生作用。
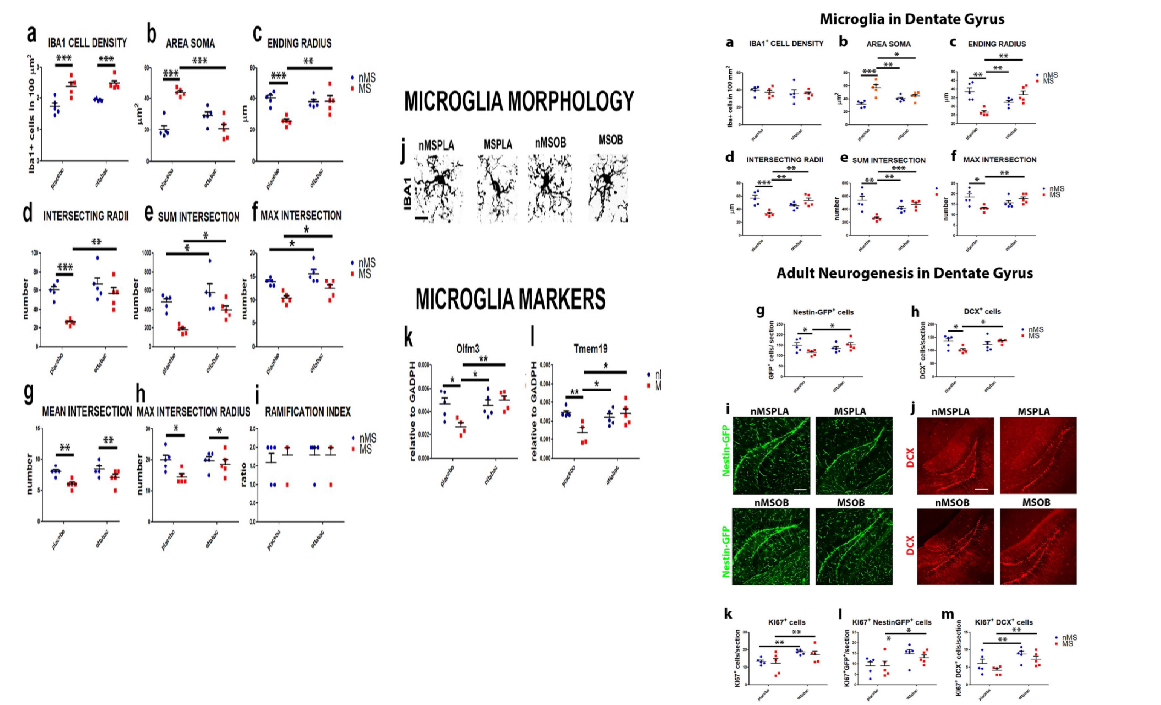
图源:Microbiome
4. 益生菌对肠道微生物的影响
研究发现,MS 对肠道微生物的 α 多样性影响显著,益生菌治疗在部分程度上恢复了肠道微生物的 α 多样性。研究还发现 MS 组经过益生菌治疗后,益生菌的主要菌群在小鼠肠道内完成了定植,即小鼠肠道内有允许益生菌定植的微生物环境。研究还分析了微生物产生短链脂肪酸(SCFAs)的酶基因水平,发现益生菌可增加 MS 组中微生物参与生成乙酸、乳酸、琥珀酸、丁酸的基因数量和丰度。总之,受到宿主的微生物种群的影响,益生菌会影响短链脂肪酸的生成,并且更易与 MS 组的微生物群相互作用产生丁酸盐。
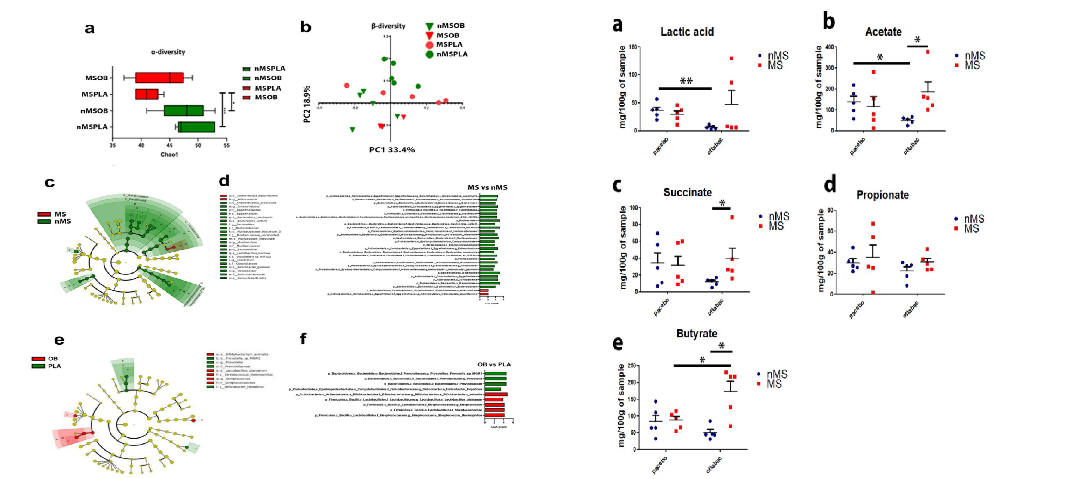
图源:Microbiome
结语
新生儿期的母子互动对子代哺乳动物的神经、心理发育至关重要,这一时期的母体分离会严重影响成年后子代的情绪调节机能及抗压能力。研究认为,补充益生菌可以提高脑组织的抗应激能力,缓解抑郁和焦虑,并可促进短链脂肪酸的生成,改善母体分离诱发的肠道微生物生态失调状况。而且,益生菌改善肠道菌群状态并产生短链脂肪酸、IL-10,进而对脑组织细胞产生影响。这些发现证实了益生菌具有改善脑-肠轴机能的重要功效,为更好的利用益生菌治疗抑郁症、肠易激综合征等心身疾病提供了病理生理学依据。
参考文献
De Santa F,et al. Farioli-Vecchioli S. Effect of a multi-strain probiotic mixture consumption on anxiety and depression symptoms induced in adult mice by postnatal maternal separation. Microbiome. 2024 Feb 19;12(1):29.