

铁死亡(Ferroptosis)是 2012 年由哥伦比亚大学 Brent Stockwell 实验室发现的一种受调控的坏死性细胞死亡方式,特征是铁依赖性脂质过氧化物的积累,其形态特征、作用方式及分子机制与其他程序性死亡方式(例如凋亡、焦亡、程序性坏死等)截然不同。细胞中有着多个内源性防御途径来对抗铁死亡,包括 GSH-GPX4、FSP1-CoQ1、DHODH-CoQ10、GCH1-BH4,以及纪念斯隆凯特琳癌症中心姜学军团队发现的 MBOAT1/2。
由于其在癌症、神经退行性疾病和器官缺血再灌注损伤等多种病理生理条件中的关键作用,铁死亡正在受到越来越多的关注。
2024 年 1 月 31 日,同济大学医学院/附属第十人民医院王平教授团队(李亚旭、冉巧、段秋慧、金佳丽为共同第一作者)在 Nature 期刊发表了题为:7-Dehydrocholesterol dictates ferroptosis sensitivity 的研究论文。
该研究发现并揭示了远端胆固醇合成通路关键酶通过调控 7-脱氢胆固醇(7-DHC)的水平来调控铁死亡敏感性的机制,表明了通过药物调控 7-DHC 水平,是一种有前途的治疗癌症和缺血再灌注损伤的新策略。


王平教授
王平,同济大学医学院/附属第十人民医院教授、博士生导师,同济大学医学院副院长,课题组主要研究肿瘤微环境调控机制与靶向,还在转化研究领域积极拓展,包括药物筛选、肿瘤免疫标志物筛选以及肿瘤免疫细胞的应用与转化等。
7-脱氢胆固醇(7- Dehydrocholesterol,7-DHC),是胆固醇生物合成途径的代谢中间体,其由 C5-甾醇去饱和酶(SC5D)合成,并被 7-DHC 还原酶(DHCR7)代谢用于胆固醇合成。作为一种不饱和甾醇,7-DHC 在其 B 环中含有一个 5,7-二烯,可作为脂肪酸过氧化物自由基的强效氢原子供体。
到目前为止,除了 7-DHC 衍生的氧化胆固醇对神经元和视网膜细胞具有细胞毒性外,7-DHC 的生物学作用我们还不清楚。
在这项研究中,研究团队使用全基因组 CRISPR-Cas9 筛选,发现了参与远端胆固醇生物合成的酶在调控铁死亡方面具有关键而又截然相反的作用。具体来说,细胞通过控制 7-DHC 的水平来调控铁死亡,MSMO1、CYP51A1、EBP 和 SC5D 是铁死亡的潜在抑制因子,而 DHCR7 则是一种铁死亡的促进因子。
从机制上讲,7-DHC 通过使用共轭二烯发挥其抗磷脂自氧化功能来控制铁死亡的监测,并保护血浆和线粒体膜免受磷脂自氧化的影响。重要的是,通过药物靶向 EBP 阻断内源性 7-DHC 的生物合成,可以诱导铁死亡并抑制肿瘤生长,而通过抑制 DHCR7 来增加 7-DHC 水平,则有效促进了癌症转移和减缓了肾脏缺血再灌注损伤的进展,支持了远端胆固醇合成通路在体内的关键功能。
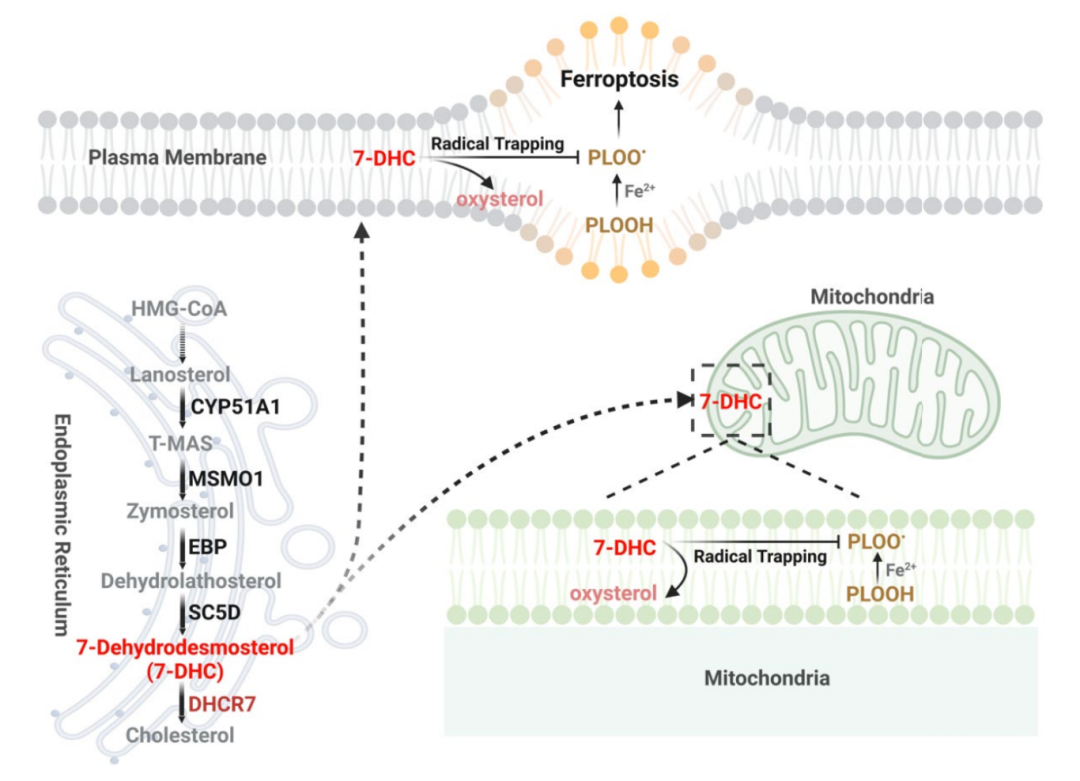
该研究揭示了 7-DHC 作为一种天然的抗铁死亡代谢物的作用及机制,并表明了通过药物调控 7-DHC 水平,是一种有前途的治疗癌症和缺血再灌注损伤的新策略。
值得一提的是,维尔茨堡大学的研究人员同期在 Nature 期刊发表了题为:7-Dehydrocholesterol is an endogenous suppressor of ferroptosis 的研究论文。
该研究揭示了 7-DHC 是铁死亡的内源性抑制性因子,证明了 7-DHC 的积累能够诱导肿瘤向铁死亡抵抗状态转变,导致癌细胞逃逸铁死亡,产生更具侵袭性的表型。

众所周知,高胆固醇水平与心血管疾病和糖尿病等健康问题有关,但大多数研究都集中于探索胆固醇是如何导致这些疾病的。这两项发表在 Nature 的新研究表明,胆固醇前体 7-DHC 作为一种抗氧化剂保护细胞免受铁死亡,这为改善癌症、缺血再灌注损伤等铁死亡相关疾病的治疗方法开辟了新道路。例如,阻断 7-DHC 合成和积累的药物,可能对某些癌症的治疗产生积极作用。
此外,美国 FDA 曾批准了一些抑制 DHCR7 酶的药物,例如曲唑酮,用于治疗抑郁症,由于其导致嗜睡的副作用,甚至被用来治疗失眠。使用曲唑酮的人,血浆中的 7-DHC 水平会升高。而这两项新研究显示,高水平的 7-DHC 会促进癌症转移,因此,有必要调查曲唑酮使用者的癌症发病率以及转移情况。