

1981 年,美国疾控中心首次报道了艾滋病(AIDS),1983 年,科学家们确定了人免疫缺陷病毒(HIV)感染是导致艾滋病的原因。40 多年后的今天,我们已经有了有效治疗和控制 HIV 病毒的方法,但仍然无法治愈艾滋病。
HIV 病毒会感染并劫持免疫系统的 CD4+T 细胞,以复制和繁殖自己的遗传物质。艾滋病患者的免疫缺陷症状,正是因为 HIV 对 CD4+T 细胞的感染和攻击,导致这些免疫细胞大量丢失所致。
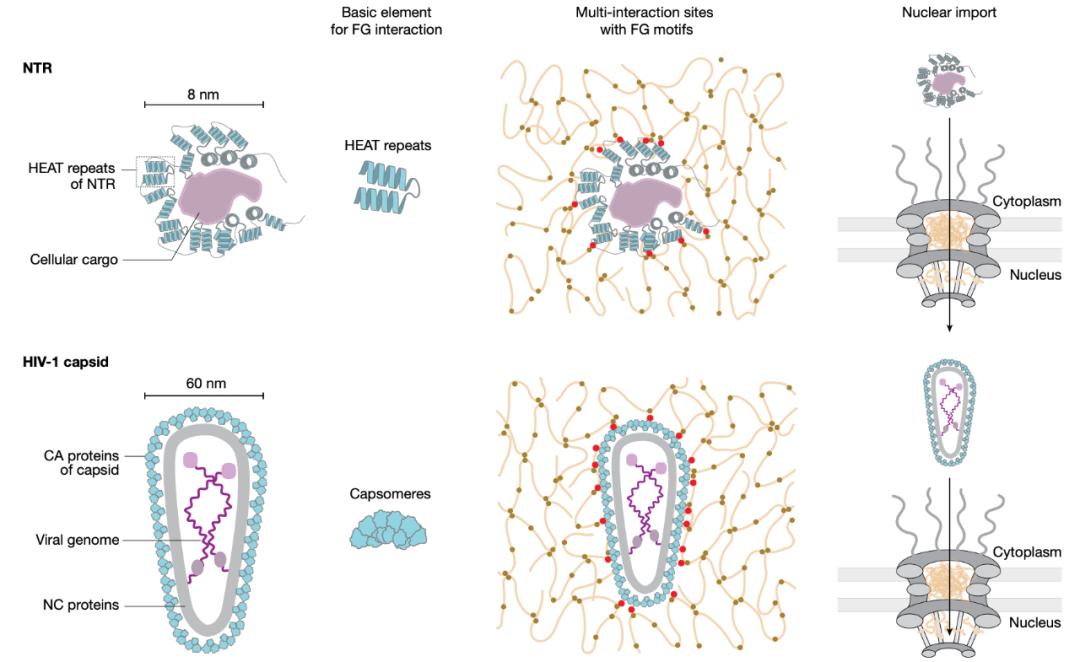
HIV 病毒为了复制和传播,必须将自己的遗传物质「偷运」进细胞核内并整合到染色体中。然而,细胞核被核膜严密保护着,阻止了不需要的蛋白质或病毒进入,并防止大分子不受控逃逸。但核膜并非完全密封,它上面有成千上万个微小的核孔,它们借助核转运蛋白(核输入蛋白、核输出蛋白)来调控特定的分子进出细胞核,单个核孔每秒钟可以传输高达 1000 个转运蛋白。
冷冻电镜断层成像技术显示,HIV 衣壳通过核孔进入了细胞核,但这里存在一个尺寸问题。核孔中央孔道的直径为 40-60 纳米,包裹病毒基因组的 HIV 衣壳直径为 60 纳米,其与转运蛋白结合后直径至少再增加 10 纳米,达到了 70 纳米,这对核孔来说太大了。HIV 衣壳所如何通过核孔进入细胞核的仍不清楚。
2024 年 1 月 24 日,马克斯-普朗克研究所 Dirk Görlich 团队和麻省理工学院 Thomas U. Schwartz 团队合作,在 Nature 期刊发表了题为:HIV-1 capsids enter the FG phase of nuclear pores like a transport receptor 的研究论文。
该研究发现,HIV 病毒衣壳已经进化成一种核转运蛋白,它可以直接突破保护细胞核免受病毒入侵的重要屏障,不依赖核转运蛋白而穿过核孔进入细胞核。由于 HIV 病毒基因组被衣壳完全封装,这也使得 HIV 基因组逃过人类细胞的细胞质中的抗病毒传感器的识别,绕过细胞的病毒防御系统,将自己的遗传物质「偷运」进细胞核,并进一步整合到染色体中。


Liran Fu 博士
核孔复合物(NPC)由约 30 种不同的核孔蛋白(Nup)构建而成,其中包括约 10 种所谓的 FG-Nup,它们将形成屏障的苯丙氨酸-甘氨酸(FG)重复结构域锚定到 NPC 支架上,其呈凝胶状,因此也被称为 FG 相(FG phase),其填充并堵塞了核孔,只允许核输出蛋白和核输入蛋白通过。
在这项研究中,研究团队发现,HIV 衣壳已经进化成一个具有核输入蛋白样表面的转运蛋白,这样就可以滑过核孔的 FG 相。因此,HIV 衣壳可以在没有转运蛋白帮助的情况下通过核孔进入细胞核,绕过防止病毒入侵细胞核的保护机制。
该研究团队还在实验室中成功复制了 FG 相。在显微镜下,FG 相呈现为微米大小的球体,能够完全阻止正常蛋白质进入,但能够吸附 HIV 衣壳及其封闭的基因组,从而衣壳被转运到核孔通道。即使移除细胞所有转运蛋白,这一情况仍能发生,这进一步表明了 HIV 衣壳自身就是一类核转运蛋白。
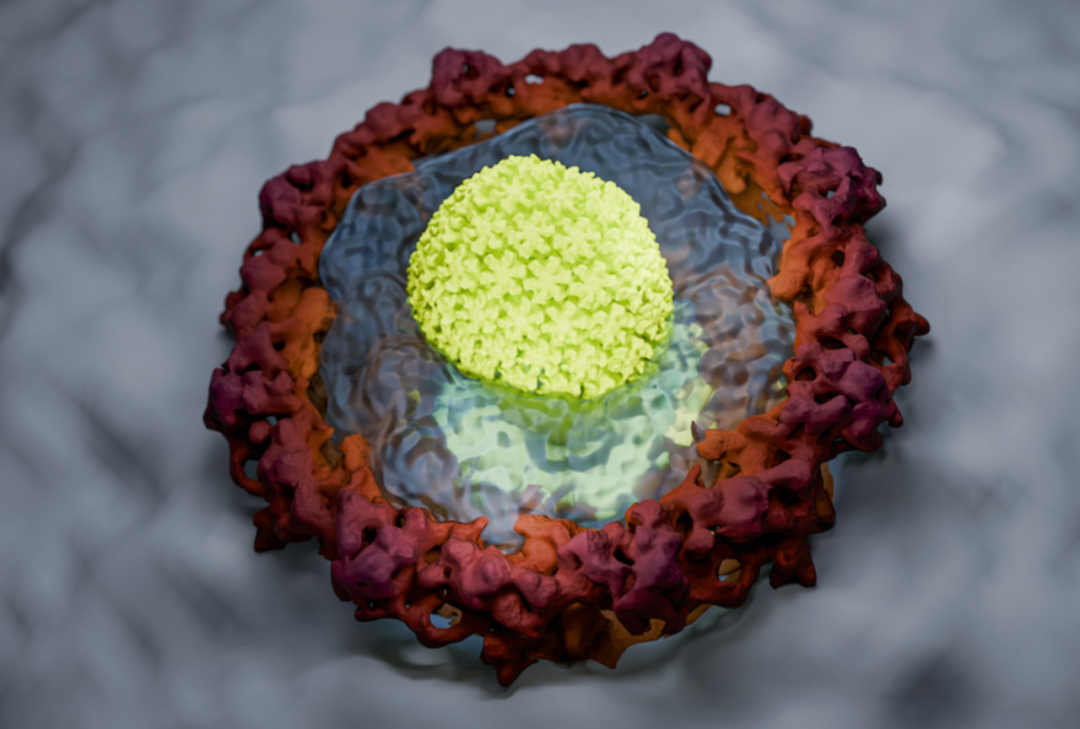
HIV 衣壳(黄绿色)进化成一种转运蛋白,通过凝胶状 FG 相进入细胞核
在某种程度上,HIV 衣壳与之前研究过的通过核孔的核转运蛋白有根本不同:HIV 衣壳完全封装了其转运的货物(HIV 基因组),这也使得 HIV 基因组没有被人类细胞的细胞质中的抗病毒传感器所识别,从而绕过细胞的病毒防御系统,将自己的遗传物质「偷运」进细胞核。
研究团队表示,目前还有许多问题有待进一步解决,例如 HIV 衣壳在哪里以及如何分解并释放其中的基因组。这项研究观察到 HIV 衣壳是一种类似于核输入蛋白的转运蛋白,这或许有助于开发更好的艾滋病治疗方法。